R. rattus y R. norvegicus, como reservorio de endoparásitos zoonóticos en Ecuador
R. rattus and R. norvegicus, as reservoirs of zoonotic endoparasites in Ecuador
Mostrar biografía de los autores
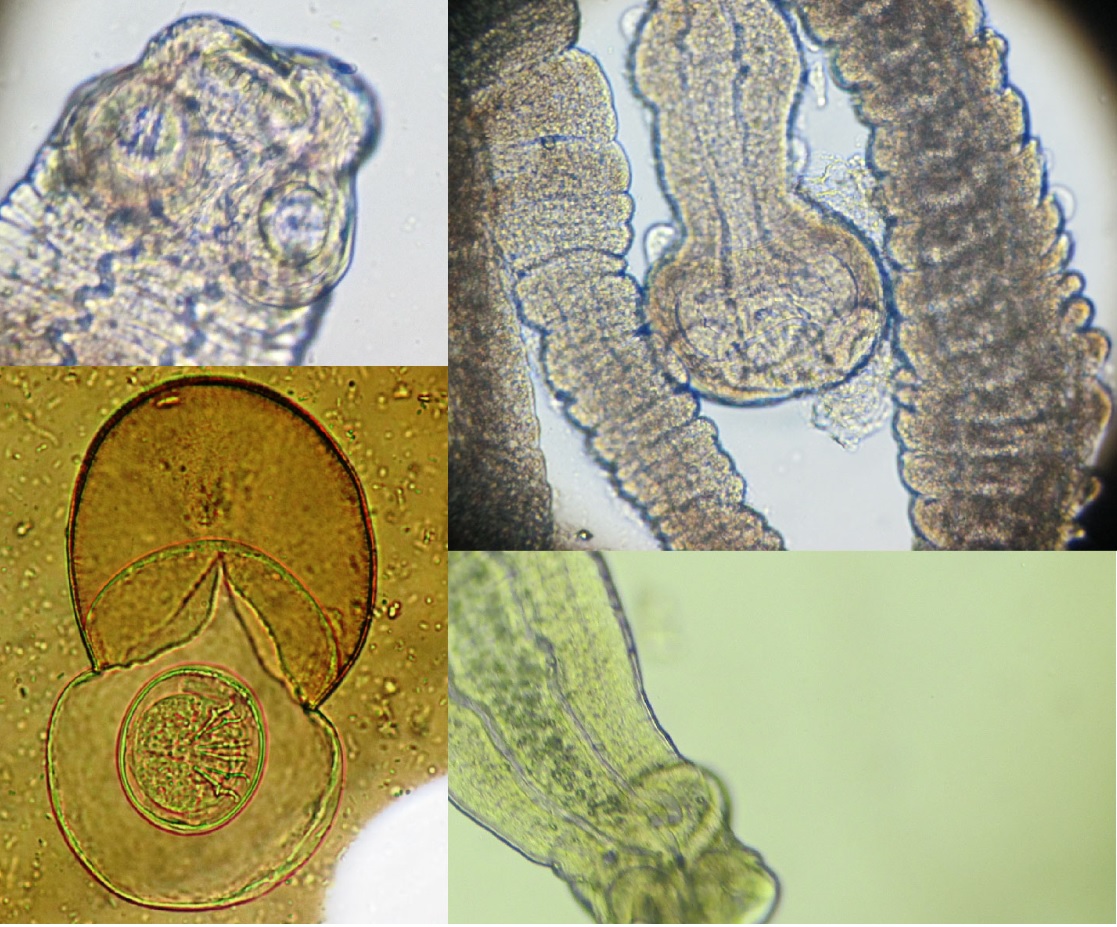
Objetivo. Recolectar información sobre la presencia de parasitosis intestinales en roedores, con énfasis en parásitos de importancia médica en humanos. Materiales y métodos. Se realizó un estudio parasitológico para detectar la presencia de helmintos en roedores en zonas urbanas y rurales de cinco provincias del Ecuador entre el 2014 y 2017. Los roedores fueron capturados y transportados al Centro Referencia Nacional de Parasitología del Instituto Nacional de Investigación en Salud Pública – Guayaquil, para su posterior análisis. Resultados. Se encontraron 125/211 (59.2%) ratas con endoparásitos, 13/20 (65%) R. rattus y 112/191 (58.6%) R. norvegicus. El nemátodo más prevalente fue Nippostrongylus brasiliensis (para ambas especies de roedores), y Heterakis spumosa, seguido por los cestodos: Hymenolepis diminuta, H. nana, Moniliformis moniliformis y Cysticercus fasciolaris. Conclusiones. La presencia de cuatro especies de cestodos zoonóticos en los roedores muestreados que viven cerca comunidades humanas, representan un riesgo potencial de infecciónpara los habitantes, especialmente en el caso de R. norvegicus (presento mayor diversidad de especies parasitarias).Por lo tanto, el control de la población de roedores en las áreas residenciales y las recomendaciones a la población local sobre el riesgo de transmisión de enfermedades a través de roedores parece ser totalmente necesario.
Visitas del artículo 866 | Visitas PDF
Descargas
- UN-Habitat. Urbanization and Development: Emerging Features. United Nations Human Settlements Programme: Nairobi, Kenya; 2016. https://unhabitat.org/sites/default/files/download-manager-files/WCR-2016-WEB.pdf
- Carvalho-Pereira T, Souza F, Santos L, Walker R, Pertile A, Oliveira D, et al. The helminth community of a population of Rattus norvegicus from an urban Brazilian slum and the threat of zoonotic diseases. Parasitol. 2018; 145(6):797–806. http://dx.doi.org/10.1017/S0031182017001755
- Meerburg BG, Singleton GR, Kijlstra A. Rodent-borne diseases and their risks for public health. Crit Rev Microbiol.2009; 35:221–270. https://doi.org/10.1080/10408410902989837
- Luis AD, Hayman DT, O’Shea TJ et al. A comparison of bats and rodents as reservoirs of zoonotic viruses: Are bats special? Proc Biol Sci. 2013; 280:20122753. http://dx.doi.org/10.1098/rspb.2012.2753
- Chaisiri K, Siribat P, Ribas A, Morand S. Potentially zoonotic helminthiases of murid rodents fromthe Indo-Chinese peninsula: Impact of habitat and therisk of human infection. Vector-Borne Zoonotic Dises. 2015; 15:73–85. https://doi.org/10.1089/vbz.2014.1619
- Kosoy M, Khlyap L, Cosson J-F, Morand S. Aboriginal and invasive rats of genus Rattus as hosts ofinfectious agents. Vector-Borne Zoonotic Dises. 2015; 15:3–12. https://doi.org/10.1089/vbz.2014.1629
- Singleton GR, Belmain S, Brown PR, Aplin K, Htwe NM. Impacts of rodent outbreaks on food security in Asia. Wildlife Research. 2010; 37:355–359. https://doi.org/10.1071/WR10084
- John A. Rodent outbreaks and rice pre-harvestlosses in Southeast Asia. Food Security. 2014; 6:249–260. https://doi.org/10.1007/s12571-014-0338-4
- Wyatt KB, Campos PF, Gilbert MTP et al. Historical mammal extinction on Christmas island (Indian Ocean) correlates with introduced infectious disease. PLOS ONE. 2008; 3:e3602. https://doi.org/10.1371/journal.pone.0003602
- Morand S, Bordes F, Chen HW, Claude J, Cosson JF, et al. Global parasite and Rattus rodent invasions: The consequences for rodent-borne diseases. Integ Zoo. 2015; 10:409–423. http://dx.doi.org/10.1111/1749-4877.12143
- Kataranovski M, Mirkov I, Belij S, Popov A, Petrović Z, Gačić Z, Kataranovski D. Intestinal helminths infection of rats (Rattus norvegicus) In the Belgrade area (Serbia): the effect of sex, age and habitat. Parasite. 2011; 18:189-196. http://dx.doi.org/10.1051/parasite/2011182189
- Duque B, Aranzazu D, Agudelo-Flórez P, Londoño A, Quiroz V, Rodas J. Rattus norvegicus como indicador de la circulación de Capillaria hepatica y Taenia taeniaeformis en la Plaza Minorista de Medellín, Colombia. Biomédica. 2012; 32:510-518. http://dx.doi.org/10.7705/biomedica.v32i4.442
- Renzo de Sotomayor C, Serrano-Martínez E, Tantaleán M, Quispe HM, Casas VG. Identificación de Parásitos Gastrointestinales en Ratas de Lima Metropolitana. Rev Inv Pe. 2015; 26(2):273-281. https://doi.org/10.15381/rivep.v26i2.11003
- Martini RL, Dorta CA. Angiostrongylus cantonensis - Emergencia en América. 1th ed. Editorial Academia: La Habana; 2016. https://www.researchgate.net/publication/312031778_Angiostrongylus_cantonensis_Emergencia_en_America
- OPS. Manual para el control integral de Roedores. Organización Panamericana de la Salud: Colombia; 2012. https://www.minsalud.gov.co/sites/rid/Lists/BibliotecaDigital/RIDE/VS/PP/SA/manual-integral-de-roedores.pdf
- Ranjbar MJ, Sarkari B, Mowlavi GR, Seifollahi Z, Moshfe A, Abdolahi KS, Mobedi I. Helminth infections of rodents and their zoonotic importance in boyer-ahmad district, southwestern iran. Ira J Parasit. 2017; 12(4):572–579. https://ijpa.tums.ac.ir/index.php/ijpa/article/view/1931
- Abad AD, Chávez VA, Pinedo VR, Tantaleán VM, Gonzáles-Viera O. Helmintofauna Gastrointestinal de Importancia Zoonótica y sus Aspectos Patológicos en Roedores (Rattus spp) en Tres Medioambientes. Rev Invst Vet Pe. 2016; 27(4):736-750. http://dx.doi.org/10.15381/rivep.v27i4.12568
- Milazzo C, Cagnin M, Di BC, Geraci F, Ribas A. Helminth Fauna of Commensal Rodents, Mus musculus (Linnaeus, 1758) and Rattus rattus(Linnaeus, 1758) (Rodentia, Muridae) in Sicily (Italy). Rev Ibero-Latinoam Parasitol. 2010; 69(2):194-198.
- CCAC. Guide to the Care and Use of Experimental Animals. 2 Edition. Canadian Council Animal Care: Ottawa, Ontario; 2017. https://www.ccac.ca/Documents/Standards/Guidelines/Experimental_Animals_Vol1.pdf
- AMM. Declaración de la AMM sobre el Uso de Animales en la Investigación Biomédica. Asociación Médica Mundial; 2016. https://www.wma.net/es/policies-post/declaracion-de-la-amm-sobre-el-uso-de-animales-en-la-investigacion-biomedica/
- Anderson RC, Chabaud AG, Willmott S. Keys to the nematode parasites of vertebrates. Archivalvolume. Wallingford, UK: CAB International; 2009. https://www.cabi.org/bookshop/book/9781845935726/
- CDC. EpiInfo TM. Centers Disease Control; 2017. https://www.cdc.gov/epiinfo/index.html
- Franssen F, Swart A, Knapen F, Giessen J. Helminth parasites in black rats (Rattus rattus) and brown rats (Rattus norvegicus) from different environments in the Netherlands. Infect Ecol Epidemiol. 2016; 6:314-333. http://dx.doi.org/10.3402/iee.v6.31413
- Simões OR, Luque JL, Gentile R, Rosa MCS, Costa-Neto S, Maldonado A. Biotic and abiotic effects on the intestinal helminth community of the brown rat Rattus norvegicus from Rio de Janeiro, Brazil. J Helminthol. 2014; 90(1):21-27. http://dx.doi.org/10.3402/iee.v6.3141310.1017/S0022149X14000704
- Coomansingh C, Pinckney RD, Bahaiyat MI, Chikweto A, Bitner S, Baffa A, Sharma R. Prevalence of endoparasites wild rats in Grenada. St. George´s University. West Ind Vet J. 2009; 9(1):17-21. https://sta.uwi.edu/fms/vet/documents/3.pdf
- Akande AO. A study on wild rat behaviour and control on a pig farm. Master of Science Programme in Veterinary Medicine for International Students. Swedish: University of Agricultural Sciences; 2011. https://stud.epsilon.slu.se/3357/
- Gonçalves AL, Belizário TL, Pimentel JB, Penatti MP, Pedroso RS. Prevalence of intestinal parasites in preschool children in the region of Uberlândia, State of Minas Gerais, Brazil. Rev Soc Bras Med Trop. 2011; 44(2):191–193. https://doi.org/10.1590/S0037-86822011005000022
- Al-Salihi KA, Sheikh A, Saied H. Highly prevalence of Strobilocercus fasciolaris infection associated with gastroentropathy and hepatic fibrosarcoma between laboratory rats in experimental gropus. Afri J Anim Biomed Sci. 2009; 4(2):6-10. https://www.ajol.info/index.php/ajbr/issue/archive/2
- Rodríguez-Vivas R, Panti-May J, Parada-López J, Hernández-Betancourt S, Ruiz-Piña H. The occurrence of the larval cestode Cysticercus fasciolaris in rodent populations from the Cuxtal ecological reserve, Yucatan, Mexico. J Helminthol. 2011; 85(4):458-461. http://dx.doi.org/10.1017/S0022149X10000817























