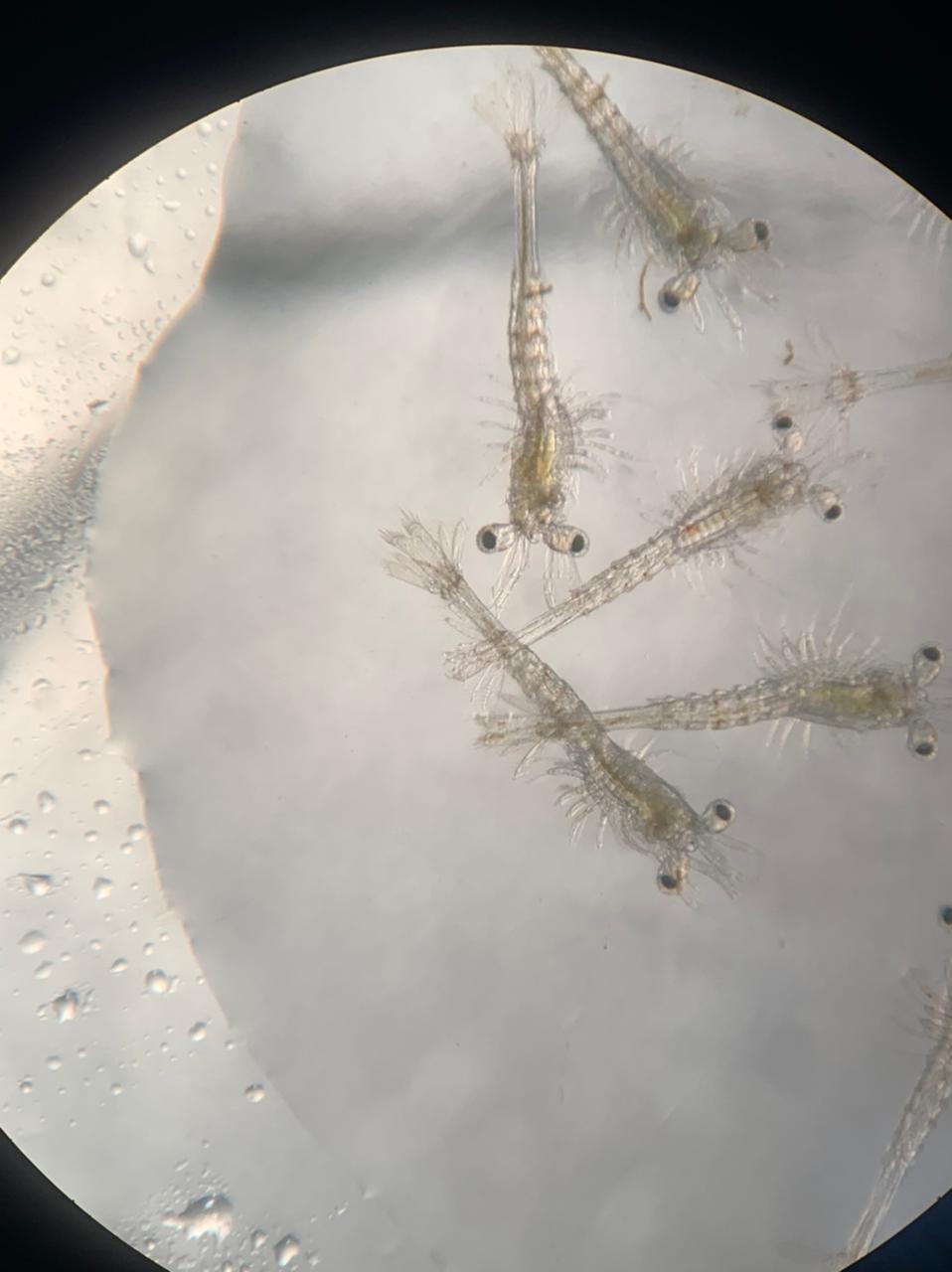
Supervivencia, desarrollo y crecimiento de larvas de Penaeus vannamei alimentadas con dietas tradicionales y no-tradicionales
Survival, development, and growth of Penaeus vannamei larvae fed on traditional and non-traditional diets shrimp larvae feeding

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial-CompartirIgual 4.0.
Mostrar biografía de los autores
Objetivo. Evaluar el efecto de dietas tradicionales (Thalassiosira weissflogii y nauplios de Artemia) y otras dos alternativas (no tradicionales) a base de microalgas y rotíferos sobre la supervivencia, el desarrollo y crecimiento de larvas nauplio V (NV) hasta el día de cambio a postlarvas (PL1) de camarón Penaeus vannamei. Materiales y Métodos. Se realizaron dieciséis réplicas (unidades experimentales) para cada una de las tres dietas utilizadas. Las larvas se colocaron en contenedores de 12 L a 35 ups, 30°C y una densidad de 200 larvas/L. La supervivencia, etapa del desarrollo y el crecimiento se determinaron al inicio, cada 24 h y al final del experimento (PL1: día 8). A los datos obtenidos se les aplicó un ANOVA de una vía. Resultados. La dieta no tuvo influencia (p>0.05) sobre supervivencia y el peso. La supervivencia osciló entre 30.4% (dieta alternativa B) y 28.5% (dieta tradicional A). El desarrollo, longitud y peso más bajo a PL1 fue encontrado con la dieta tradicional (6.71; 3.53 mm; 58.37 µm/organismo) en comparación con las dietas alternativas suministradas B y C (6.86-6.76; 3.79-3.82 mm; 60.7-65.0 µm/organismo). Conclusiones. La alimentación más adecuada para la supervivencia, desarrollo y crecimiento larval se obtuvieron con las dietas alternativas no tradicionales (B y C) compuestas de rotíferos.
Visitas del artículo 466 | Visitas PDF
Descargas
- Arzola GJ, Piña VP. Nieves SM, Medina JM. Supervivencia de postlarvas de camarón blanco Litopenaeus vannamei a diferentes salinidades y temperaturas. Rev MVZ Cordoba. 2013; 18(Supl):3618-3625. https://doi.org/10.21897/rmvz.127
- Medina-Jasso M, Arzola-González JF, Piña-Valdez P, Nieves-Soto M. Effect of the diet traditional and non-traditional on the respiration and excretion in larvae of white shrimp Litopenaeus vannamei. Rev MVZ Cordoba. 2015; 20(Supl):4917-4928. https://doi.org/org/10.21897/rmvz.7
- Bermudes-Lizárraga J, Nieves-Soto M, Medina-Jasso A, Piña-Valdez P. Efecto de temperatura y salinidad sobre la supervivencia y desarrollo larval de Litopenaeus vannamei. Rev MVZ Cordoba. 2017; 22(2):5844-5853. https://doi.org/10.21897/rmvz.1022
- Gallardo P, Martínez G, Palomino G, Paredes A, Gaxiola G, Cuzon G, et al Replacement of Artemia franciscana nauplii by microencapsulated diets: effect on development, digestive enzymes, and body composition of white shrimp, Litopenaeus vannamei, larvae. J World Aquac Soc. 2013; 44(2):187–197. https://doi.org/10.1111/jwas.12031
- Varela-Mejias A, Varela-Moraga T. La camaronicultura como fuente sustentable de alimentos de origen animal. Logros, retos y oportunidades. Eco Des Sos. 2019; 1(1):1-12. https://revistas.ulatina.ac.cr/index.php/ecologia/article/view/306
- Jamali H, Ahmadifard N, Abdollahi D. Evaluation of growth, survival and body composition of larval white shrimp (Litopenaeus vannamei) fed the combination of three types of algae. Int Aquat Res. 2015; 7:115-122. https://doi.org/10.1007/s40071-015-0095-9
- Bermudes-Lizárraga JF, Nieves-Soto M, Medina-Jasso MA, Román-Reyes JC, Flores-Campaña LM, Ortega-Salas AA, et al Efecto de la temperatura y salinidad en el crecimiento larval de Litopenaeus vannamei. Rev Biol Mar Oceanogr. 2017; 52(3):611-615. http://dx.doi.org/10.4067/S0718-19572017000300016
- López-Elías JA, Nevárez-Pineli ML, Aguirre-Hinojoza E, Martínez-Córdova LR, Valdez-Holguin JE. Estudio económico de laboratorios de producción de larvas de Litopeneaus vannamei (camarón blanco). Biotecnia 2013; 15(1):19-24. https://biotecnia.unison.mx/index.php/biotecnia/article/view/131
- García N, López-Elías JA, Miranda A, Martínez-Porchas M, Huerta N, García A. Effect of salinity on growth and chemical composition of the diatom Thalassiosira weissflogii at three culture phases. Lat Am J Aquat Res 2012; 40(2):435-440. https://doi.org/10.3856/vol40-issu2-fulltext-18
- Ruíz-Guzmán JA, Jiménez-Velásquez CA, Gomes-Romero C, Prieto-Guevara MJ. Experimental culture of Cyclopina sp with differents microalgae’s species. Rev Colomb Cienc Pecu. 2012; 25(1):97-105. https://www.proquest.com/docview/1247121829
- Jeyaraj N, Santhanam P. Influence of algal diet on population density,egg production and hatching succession of the calanoid copepod, Paracalanus parvus (Claus, 1863). J Algal Biomass Utln. 2013; 4(1):1-8. http://storage.unitedwebnetwork.com/files/521/2824198906703a2f941bf82d0396f1c0.pdf
- Rojo-Cebreros AH, Román-Reyes JC, Rodríguez-Montes de Oca GA, Nieves-Soto M, Piña-Valdez P, Medina-Jasso MA. Balance energético del rotífero Brachionus rotundiformis Tschugunoff 1921, alimentado con cuatro especies de microalgas. Univ Cienc. 2012; 28(3):231-244. https://doi.org/10.19136/era.a28n3.12
- Román-Reyes JC, Castañeda-Rodríguez DO, Castillo-Ureta H, Bojórquez-Domínguez R, Rodríguez-Montes de Oca GA. Dinámica poblacional del rotífero Brachionus ibericus aislado de estanques para camarón, alimentado con diferentes dietas. Lat Am J Aquat Res 2014; 42(5):1159-1168. http://doi.org/10.3856/vol42-issue5-fulltext-19
- Arreguin-Rebolledo U, Sarma N, Rodríguez-Montes de Oca GA, Monroy-Dosta MC, Tello-Ballinas JA, Sarma SSS, Román-Reyes JC. The potential use of the euryhaline rotifer Proales similis for larval rearing of the freshwater pike silverside Chirostoma estor estor. Aquacult 2021; 534:1-8. https://doi.org/10.1016/j.aquaculture.2020.736246
- Ruiz-Toquica JS, Becerra-Real LM, Villamil-Díaz LM. Evaluación del efecto de Bacillus firmus C101 en el crecimiento de poslarvas de Litopenaeus vannamei Boone (camarón blanco) y Brachionus plicatilis s.s. Müller (rotífero). Bol Invest Mar Cost 2020; 49(1):63-80. https://doi.org/10.25268/bimc.invemar.2020.49.1.774
- Piña P, Nieves M, Voltolina D, Chavira-Ortega C. Crecimiento, desarrollo y supervivencia de mysis de Litopenaeus vannamei alimentadas con nauplios de Artemia y con el rotífero Brachionus plicatilis. Rev Invest Mar 2004; 25(3):245-251.
- Nieves-Soto M, Lozano-Huerta R, López-Peraza DJ, Medina-Jasso MA, Hurtado-Oliva MA, Bermudes-Lizárraga JF. Effect of the enrichment time with the tuna orbital oil emulsion on the fatty acids profile of juveniles of Artemia franciscana. Aquac Fish 2021; 6(1):69-74. https://doi.org/10.1016/j.aaf.2020.03.008
- Piña-Valdez P, Arzola-González JF, Nieves-Soto M, Medina-Jasso M. Efecto combinado de temperatura y salinidad en el consumo de oxígeno en postlarvas de camarón blanco Litopenaeu vannamei. Bol Inst Pesca 2015; 41(1):89-101. https://intranet.institutodepesca.org/41_1_89-101.pdf
- Zar JH. Biostatistical analysis. Upper Saddle River, USA: Prentice-Hall Inc; 2010.
- Coelho RTI, Yasumaru FA, Passos MJACR, Gomes V, Lemos D. Energy budgets for juvenile Pacific whiteleg shrimp Litopenaeus vannamei fed different diets. Braz J Oceanogr 2019; 67:1-8.
- http://dx.doi.org/10.1590/S1679-87592019024306701
- Rodríguez Canché LG, Maldonado-Montiel TDNJ, Carrillo-Navarro LA. Calidad biológica y bioquímica de la población de Artemia (Anostraca: Artemiidae) localizada en las salinas de Real de Salinas, Calkiní, Campeche, México. Rev Biol Trop 2006; 54(4):1283-1293. https://doi.org/10.15517/rbt.v54i4.3104
- Campaña-Torres A, Martínez-Córdova LR, Martínez-Porchas M, López-Elías JA, Porchas-Cornejo MA. Productive response of Nannochloropsis oculata, cultured in different media and their efficiency as food for the rotifer Brachionus rotundiformis. J Exp Bot 2012; 81:45-50. http://www.revistaphyton.fund-romuloraggio.org.ar/vol81/6-CAMPANA-TORRES.pdf
- Gelabert R, Brito R, Gaxiola G, Castro T, Rosas C. Efecto de nauplios de "Artemia franciscana" enriquecidos sobre el crecimiento, supervivencia y resistencia al estrés de postlarvas (PL5-PL40) de "Litopenaeus vannamei" (Boone, 1931). Univ Cienc 2008; 24(1):29-39. http://dx.doi.org/10.19136/era.a24n1.277
- Seychelles LH, Happe S, Palacios E, Ludwig M, Hollmer S, Ehlers RU, et al Successful rearing of whiteleg shrimp Litopenaeus vannamei larvae fed a desiccation-tolerant nematode to replace Artemia. Aquac Nutr 2018; 24:903-910. https://doi.org/10.1111/anu.12626
- Ordóñez-Mejía CA, Galarza-Mora WG, Quizhpe-Cordero P, Quijije-López LJ. Efecto de la combinación de alimento artificial y biomasa de Artemia sp en cría intensiva de postlarvas de Litopenaeus vannamei. Dom Cien 2021; 7(2):1167-1189. https://dominiodelasciencias.com/ojs/index.php/es/article/view/1854
- Cobo ML, Wouters R, Wille M, Sonnenholzner S, Sorgeloos P. Evaluation of frozen umbrella‐stage Artemia as first animal live food for Litopenaeus vannamei (Boone) larvae. Aquac Res 2015; 46:2166-2173. https://doi.org/10.1111/are.12372
- Martínez-Córdova LF, Martínez-Porchas M, López-Elías JA, Enríquez-Ocaña LF. Uso de microorganismos en el cultivo de crustáceos. Biotecnia 2014; 16(3):50-55. https://biotecnia.unison.mx/index.php/biotecnia/article/view/141
- Rodríguez EO, López-Elías JA, Aguirre-Hinojosa E, Garza-Aguirre MDC, Constantino-Franco F, Miranda-Baeza A, et al Evaluation of the nutritional quality of Chaetoceros muelleri schutt (Chaetocerotales: Chaetocerotaceae) and Isochrysis sp. (Isochrysidales: Isochrysidaceae) grown outdoors for the larval development of Litopenaeus vannamei (Boone, 1931) (Decapoda: Penaeidae). Arch Biol Sci 2012; 64(3):963-970. https://doi.org/10.2298/ABS1203963R
- Yoshimatsu T, Hossain MA. Recent advances in the high-density rotifer culture in Japan. Aquacult Int 2014; 22:1587-1603. https://doi.org/10.1007/s10499-014-9767-5